(当記事は、アメリカでの法律、研究に基づいて作成されています)
2025年12月18日、トランプ大統領が、大麻を「より危険性の低い薬物」と位置づけて再分類(スケジュール変更)する大統領令に署名したというニュースが、大きく報じられました。
「ついにアメリカでも合法化か」そんな見出しや期待が世界を駆け巡っています。
しかし、結論から言えば、スケジュール変更は「合法化」を意味しません。
それでもなお、この動きがアメリカの大麻政策における歴史的な一歩であることは間違いなく、医療・産業・金融・税制、そして患者の生活にまで、深い影響を及ぼす転換点になろうとしています。
日本では今、2024年12月に75年ぶりに法改正したばかりで、「海外では何が起きているのか」「その先にどんな現実が待っているのか」が、十分に共有されているとは言えません。
だからこそ私たちは、このニュースを、将来の日本を考えるための材料として、正確に伝える必要があると考えました。
今回お届けするのは、業界経験20年超。
アメリカの大麻・ヘンプ産業に特化した税務・会計ファーム『BTA Cannabis CPA Tax』の創業者であり、専門メディア『WeedingTheNews』の編集長でもあるトーマス・アンダーセン(Thomas Andersen)氏による寄稿です。
若かりし頃は大麻のディーラー。
そこから警察分析官へ華麗なる転身を経て、今に至る、イカついキャリアの持ち主!

制度の内側を知る当事者だからこそ語れる、期待と現実、その光と影。
表層的なニュースでは見えてこない「本当の意味」を、日本の読者に向けて共有してもらいました。
ここから先は、「スケジュール変更とは何か」「それは誰にチャンスをもたらし、誰に新たな壁をつくるのか」そして「患者の生活はどう変わるのか」そのリアルな姿を、順にひもといていきます。
新薬が患者に届くまでにかかる「本当の代償」

汗、涙、海水—水はあらゆる症状を癒してくれる
—アイザック・ディネーセン
もし本当に、そんなに単純な話で済むのなら、どれほどいいでしょう。
けれど現実医療の世界では、「治療」は、たいてい何十億ドルものコストを意味します。
FDAの医薬品承認にかかる、あまりに高いハードル
人々が「薬の開発」と聞いて思い浮かべるのは、白衣を着た科学者が奇跡のような成分を発見し、それがすぐ患者のもとに届く――そんな光景かもしれません。
けれど、現実はまったく違います。
ひとつの新薬が、研究室のベンチから患者のベッドサイドに届くまでには、平均で10〜15年。
かかる費用は、最大で26億ドルにも上ります。
なぜ、そこまでの時間とお金が必要なのか。理由はシンプルですが、重たい現実を突きつけます。
前臨床試験という最初の壁
人が一錠も口にする前に、すでに何百万ドルもの資金が消えていきます。
数十種類の化合物が試されますが、ヒト試験に進む価値があると判断されるのは、その中のほんの一部にすぎません。
臨床試験(第I〜III相)の過酷さ
ここでは、大規模な患者集団、長い試験期間、そして綿密なモニタリングが求められます。
どの段階で失敗しても、何年もの努力と何百万ドルもの投資が一瞬で水泡に帰す。
実際、候補薬の約9割は途中で脱落し、その損失は投資家が引き受けることになります。
FDAによる厳格な規制審査
最後に待ち構えるのが、FDA(アメリカ食品医薬品局)の審査です。
基準は厳しく、時間もかかる。申請手数料だけで数百万ドルに達し、承認までに何年も要することは珍しくありません。
こうした過酷なプロセスは、薬の安全性と有効性を守るために欠かせないものです。
しかし同時に、ひとつの冷酷な現実も生み出します。
ゴールラインにたどり着けるのは、莫大な資金力を持つ企業だけ。
参入障壁はあまりにも高く、多くの小規模なイノベーターは、挑戦することすらできないのが実情です。
特別な存在としての大麻
大麻は、何十年にもわたって研究され、使われ、そして議論され続けてきました。
もし大麻がスケジュールIIIに移行すれば、大麻由来の医薬品が、FDAの正式な承認ルートに乗る道が開かれます。
ただし、それは「開発が楽になる」ことを意味しません。
再分類されたからといって、新薬開発にかかる莫大なコスト構造が、魔法のように消えるわけではないのです。
事例研究:エピディオレックス(Epidiolex)
2018年、エピディオレックスは希少な小児てんかんを対象に、FDAが承認した初の大麻由来医薬品となりました。
この出来事は歴史的でしたが、同時に、大麻医薬品開発の現実を浮き彫りにするものでもありました。
まず、開発した『GWファーマシューティカルズ』は、決してゼロからの挑戦ではありませんでした。
長年にわたる研究と、経験的な使用実績の積み重ねが、CBDという成分に“先行優位”をもたらし、どこに賭けるべきかという判断の土台になっていたのです。
それでも同社は、数億ドル規模の投資を行いました。
複数の国にまたがる厳格な臨床試験を実施し、FDAの基準を満たすために、研究者や統計家からなる大規模な体制を動員しました。
そして、その結果として生まれたのは、ディスペンサリーで売られているような「医療大麻」ではありません。
高度に特定化され、特許で守られ、処方箋でのみ入手でき、対象疾患が厳密に定義された「医薬品」でした。
エピディオレックスは、二つの真実を同時に示しました。
ひとつは、大麻成分であっても、FDAという金字塔とも言える承認制度を通過できるということ。
そしてもうひとつは、そこに到達するには、大半の大麻事業者には到底手の届かない規模の資本が必要になるという現実です。
市場機会と、広がる格差
もし大麻がスケジュールIIIに移行すれば、それは長年待ち望まれてきた連邦政策の転換として、大きな歓迎をもって受け止められるでしょう。
しかし、その祝祭ムードの裏側には、ひとつの逆説が潜んでいます。
再分類は、巨大製薬企業にとっては新たな市場への扉を開く一方で、これまで現場で医療アクセスを切り拓いてきた小規模な大麻企業にとっては、むしろ参入のハードルを押し上げる可能性があるのです。
そして、疑問は尽きません。
医療専用州にある大麻ディスペンサリーは、今後どうなっていくのか。
FDA承認の大麻医薬品を扱うために、各店舗に薬剤師を常駐させる必要が出てくるのか。
制度が動けば、市場の風景も大きく変わる。
その先に待つのが、機会の拡大なのか、それとも格差の拡大なのか?
まだ答えは見えていません。
大麻の再分類は、合法化ではない
医療用プログラムの黎明期から、今日の成人向け(嗜好用)市場の急拡大に至るまで。
あらゆる規制の曲折をくぐり抜けてきた大麻業界の経営者として、私はこれまで、連邦レベルでの「再分類」という話題が、しばしば「全米一斉合法化」という夢物語をかき立てる場面を何度も見てきました。
しかし現実は違います。
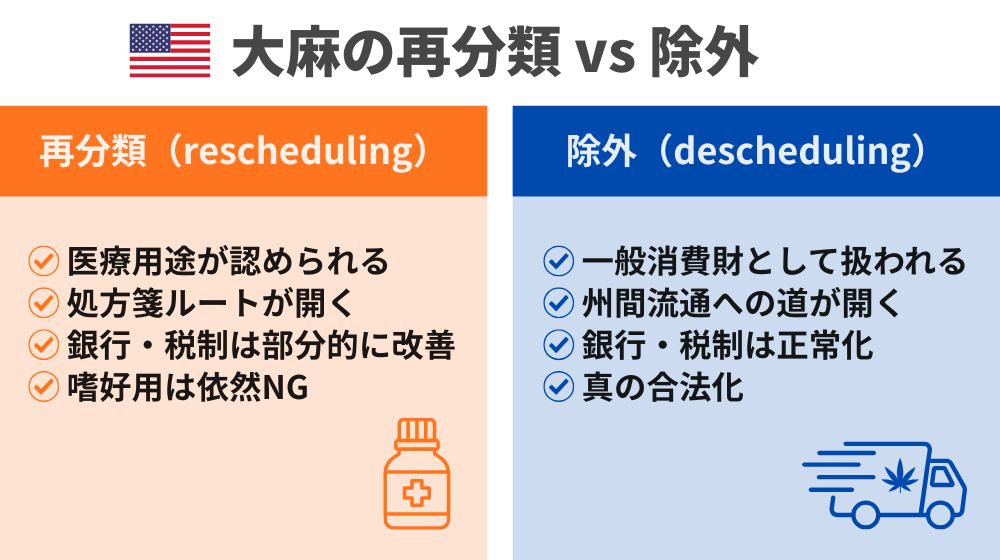
大麻の再分類だけで、大麻が本当の意味で合法化されることはありません。
ここでは、再分類(rescheduling)と除外(descheduling)の違いを明確にしたうえで、再分類がどのように処方薬としての道を開くのか、そしてなぜ、真の連邦レベルでの合法化は「除外」だけが実現し得るのかを、順に見ていきます。
大麻の再分類 vs. 除外:その違いを整理する
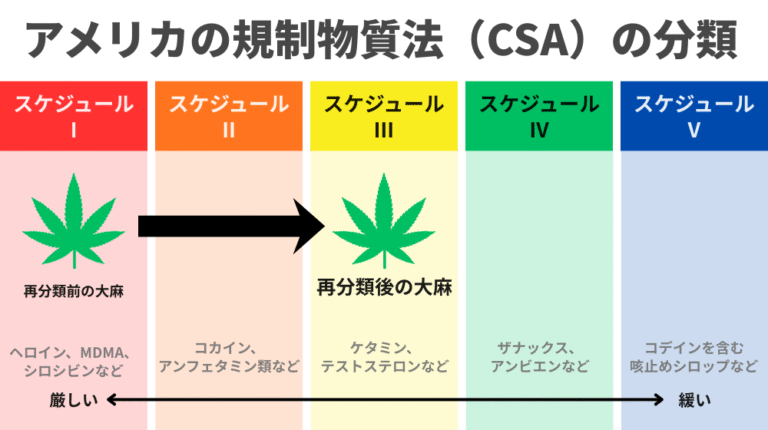
米国の規制薬物法(Controlled Substances Act:CSA)の下でいう「再分類」とは、 司法長官が規則制定の手続きを通じて、ある物質をスケジュール間で移動させることを意味します。
その判断は通常、HHS(保健福祉省)やFDAによる医学的・科学的評価を踏まえて行われます。
法的な根拠は21 U.S.C. §811に定められており、各スケジュールの基準は§812に規定されています。
▶︎ 21 U.S. Code § 811 – Authority and criteria for classification of substances(Legal Information Institute)
▶︎ 21 U.S. Code § 812 – Schedules of controlled substances(Legal Information Institute)
重要なのは、たとえ大麻がスケジュールIから外れたとしても、 スケジュールII〜Vのいずれかに位置づけられる限り、依然として「規制薬物」であるという点です。
その場合、連邦政府による管理・登録・生産量の割当・罰則は引き続き適用されます。
一方で、除外(descheduling)は、まったく別の概念です。
これは、大麻をCSAそのものから完全に外すことを意味します。
そうなれば、DEA(United States Drug Enforcement Administration:米国麻薬取締局)によるスケジューリングや生産量割当の権限は終了し、監督の役割は、他の連邦機関へと移行することになります。
たとえば
・FDA:製品の安全性や表示の監督
・財務省のTTB:物品税や一部の処方・製剤承認
・IRS:通常ルールに基づく課税
といった形で、それぞれの分野を担当する機関が関与することになります。
なお、ここでいう「割当(クオータ)権限」とは、オピオイドや興奮剤など、乱用の可能性がある規制薬物について、年間にどれだけ生産・供給できるかをDEAが法的に定める権限のことを指します。
大麻の再分類で実際に開かれるもの
仮に大麻がスケジュールIIIに移行した場合、 処方薬として扱われる道が開かれることになります。
ただし、それが認められるのは、 FDAの医薬品承認プロセス(すなわち、IND/NDA、表示、ファーマコビジランスなど)をすべてクリアした製品に限られます。
供給の面では、DEAが、 医療需要に応じた年間の総生産割当量を設定し、 必要に応じて年の途中で調整することもできます。
この仕組みは、21 CFR §1303.11などに定められています。
▶︎ Development & Approval Process | Drugs(FDA)
▶︎ 21 CFR § 1303.11 – Aggregate production quotas.(Legal Information Institute)
▶︎ PART 1303—QUOTAS(Electronic Code of Federal Regulations)
実務上のポイントは、次の一文に集約されます。
大麻の再分類は、連邦政府が「医療用途」を正式に認めることを意味するが、成人向け(嗜好用)の小売を、連邦レベルで合法化するものではない。
つまり、FDA/DEAの枠組みの中で、正式に承認・管理された処方薬ルートは開かれる。
しかしその枠組みの外で行われる、処方を伴わない生産・流通・所持は、たとえ州法で認められていても、連邦法上は依然として違法のままです。
大麻の再分類が産業に与える影響:銀行・税制(280E)・小売
大麻の再分類は、単に法的な位置づけを変えるだけでなく、産業の成長環境そのものにも大きな影響を及ぼします。
とりわけ重要なのが、銀行、税制、そして小売の在り方です。
① 銀行(金融アクセス)
金融機関は現在、2014年のFinCENガイダンスに基づき、 厳格なBSA/AML(マネーロンダリング対策)管理と、 大麻関連取引に特有のSAR(疑わしい取引の届出)を行いながら、 慎重にこの業界と向き合っています。
仮に再分類が行われたとしても、 大麻が規制薬物である限り、 銀行は引き続き評判リスクや規制リスクを慎重に見極める必要があります。
つまり、金融アクセスがすぐに普通になるわけではありません。
② 連邦税制(IRC §280E)
内国歳入法280E条項は、 スケジュールIまたはIIの物質を「取引」する事業者に対して、 通常の必要経費の控除を認めないという厳しい規定です。
しかし、大麻がスケジュールIIIに移行すれば、 最終規則の発効後は、原則として280Eの適用対象から外れることになります。
これは、税後利益の大幅な改善につながり、 事業者にとっては極めて大きな転換点となります。
③ 小売形態
再分類は、エディブル、ベイプ、飲料といった非処方の消費者向け製品を、連邦レベルで合法化するものではありません。
これらの製品が連邦法上認められるのは、FDAの権限の下で、承認薬などとして合法的に販売される場合に限られ、それ以外は引き続き州法による規制の領域にとどまります。
「除外」こそが、本当の大麻合法化への道
除外(descheduling)とは、大麻を規制薬物法(CSA)そのものから外すことを意味します。
大麻の再分類ではなく、この変更こそが、全米での商取引を「普通のビジネス」として成り立たせる道です。
除外が実現すれば、次のような変化が起こります。
・CSAによる管理の消滅:DEAのスケジュール管理や生産量の割当、事業者登録が不要になります。
・銀行取引の正常化:特別扱いではなく、通常のBSA/AML対応のもとで、銀行が取引できるようになります。
・税制の公平性の回復:280E条項が適用されなくなり、一般企業と同様に、通常の経費控除が認められます。
・規制の所管移行:監督は、TTB(Alcohol and Tobacco Tax and Trade Bureau:アルコール・たばこ税貿易局)やFDAといった、一般消費財や医薬品の規制に慣れた機関へと移っていきます。
ただし、除外は各州に大麻の合法化を強制するものではありません。
いわゆるドライ州(大麻の合法化を認めない州)が、引き続き禁止を選ぶことも可能です。
それでも、CSAという連邦法の壁が取り払われることで、将来的には、連邦および州の新たなルールの下で、州をまたいだ流通が合法的に行える余地が生まれます。
そして何より、いま企業価値や成長を押し下げている銀行取引と税制上の足かせが解消されることになります。
現状チェック:連邦の大麻の再分類はどこまで進んでいるか
米司法省(DOJ)は、大麻をスケジュールIIIに移すことを提案し、正式な規則制定と行政審理プロセスを開始しました。
2024年5月21日に連邦官報で規則案公告(NPRM)が公表されています。
DOJ(アメリカ司法省)は、大麻をスケジュールIIIへ移行させる案を提示し、 これに基づく正式な規則制定プロセスと行政審理をすでに開始しています。
その第一歩として、2024年5月21日、 規則案公告(NPRM:Notice of Proposed Rulemaking)が 連邦官報に公表されました。
事業者向けプレイブック:今、何をすべきか
制度が動くいま、事業者に求められるのは「様子見」ではなく、複数のシナリオを見据えた準備です。
FDA水準のコンプライアンス体制を整える
処方薬ルートへの参入を視野に入れるなら、 品質システム(CMC、GLP/GCP/GMP)の構築や、 治験を担うパートナーの確保を、今から進めておく必要があります。
「280E後」を前提に収益モデルを描く
スケジュールIIIが確定すれば、280E条項の適用終了を前提にした経営が可能になります。
価格戦略や再投資計画は、そのシナリオを織り込んで見直しておきましょう。
銀行対応は引き続き慎重に
連邦レベルでの位置づけが完全に整理されるまでは、FinCENガイダンスと、各金融機関のBSA/AML方針に沿った運用を続けることが不可欠です。
「州法が地図を決める」ことを忘れない
連邦の動きがあっても、州ごとの禁止や規制は残ります。
市場参入や供給網の設計は、州ごとに組み立てる発想が欠かせません。
大麻の再分類は、大麻の医療的価値を公式に認め、処方と研究の道を大きく広げます。
一方で、除外こそが、銀行取引を「普通」に戻し、280Eを撤廃し、真の州間商取引への扉を開くものです。
賢明な事業者は、どちらか一方に賭けるのではなく、両方のシナリオに備えます。
つまり、今日をコンプライアンスで乗り切りながら、明日の統合された全米市場に向けて、着実に布石を打つ。
それが、いま取るべき戦略だと言えるでしょう。
患者の体験

大麻の再分類は、患者のアクセスのあり方を根本から変える転換点になり得ます。
最も弱い立場にある人々が、過度な経済的負担に苦しむことなく、安全で一貫性のある大麻医薬品を手にできる可能性が開かれるからです。
ここでは、こうした政策判断の影響を最も直接的に受ける人たち――患者に、焦点を当てていきます。
法的な文言や官僚的な議論の裏側には、医薬品としての大麻に頼りながら、数え切れない症状とともに日々を生きる一人ひとりの人生があります。
大麻の再分類は、そうした患者の「道のり」を、深いレベルで変える力を持っています。
それは良い方向への変化であるかもしれませんし、同時に新たな疑問や課題を生むことにもなるでしょう。
標的治療は、がんを治し、選択肢を広げる可能性を秘めています。
しかし一方で、その代償はいったいいくらになるのか?そんな問いも、私たちの前に突きつけられます。
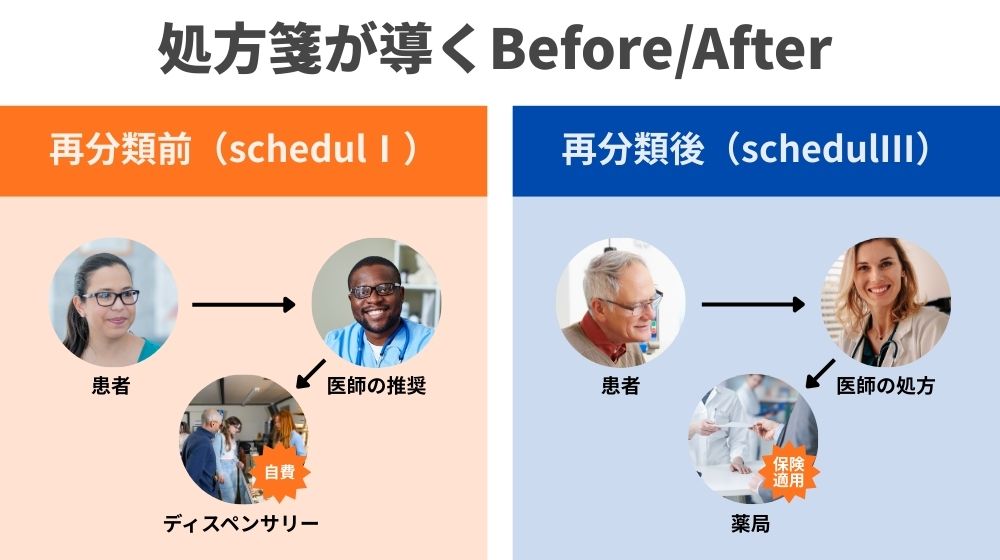
アクセスと負担:医師の「推奨」から処方箋(RX)へ
今回の議会では、これまでの再分類の試みに比べて、より多くの支持が集まっています。
患者にとっては、「H.R.4963 ― 2025年マリファナ1-to-3法」のような法案が、 一刻も早く成立してほしいという切実な状況です。
現在、大麻へのアクセスは、州ごとの規則、医師の研修や認証制度、ディスペンサリーの有無が入り混じった、いわばパッチワークのような状態にあります。
スケジュールIの下では、医師は大麻を処方することができず、州の制度が許す範囲で、あくまで「推奨」することしかできません。
その結果、患者は二重構造の医療経済に縛られ、自己負担が当たり前となり、必要な薬のために毎年莫大な費用を支払わざるを得ない状況に置かれています。
再分類がもたらす変化
再分類は、この構図を大きく変える可能性があります。
もし大麻がスケジュールIIIに移行すれば、医師はFDA承認の大麻由来医薬品を処方できるようになり、理論上は保険適用も可能になります。
患者にとっては、ディスペンサリーに並ぶ日常から、地元の薬局で処方薬を受け取る日常への転換を意味するかもしれません。
また、医療専用ディスペンサリーが、FDA承認製品を扱うために、薬剤師や薬局技師を雇用する必要が出てくる可能性もあります。
保険適用という希望
再分類は、処方薬の保険適用への道も開きます。
メディケアやメディケイドの対象となる、低所得者、固定収入の高齢者、困窮患者にとっては、医療費の負担が最も重くのしかかるだけに、制度改編によって大麻由来医薬品へのアクセスが現実のものになるかもしれません。
処方を受けるための診察費も保険でカバーされ、薬局での調剤も保険適用となる可能性があります。
一方で、新たな懸念も
ただし、再分類には別の側面もあります。
大麻が製薬パイプラインに組み込まれることで、FDA承認薬にありがちな価格の高騰を招く恐れがあるのです。
比較的手頃な価格のディスペンサリー製品に慣れてきた患者は、高額な処方薬と州市場の製品のあいだで、板挟みになる可能性も否定できません。
安全性・品質・標準化:患者が求めるもの、そして今は得られていないもの
患者の不満として、最も多く聞かれるのが「一貫性のなさ」です。
同じカンナビノイドやテルペンの含有で知られる花でも、購入する店が違えば、認証ラボでの検査結果が大きく異なることがあります。
多くの患者は、適切な医療指導もないまま製品を試され、まるで“実験台”にされているかのような感覚を抱いています。
大麻医薬品におけるインフォームド・コンセントは、いまだ発展途上と言わざるを得ません。
▶︎ What the rescheduling of marijuana might — and might not — mean for scientific research(STAT10)
FDA監督がもたらす変化
再分類は、FDAの監督を通じて、こうした状況を変える可能性があります。
FDA承認薬には、安全性・有効性・純度・用量の正確さについて、極めて厳格な試験が義務づけられます。
それは患者にとって、自分が何を、どれだけ摂取しているのかを確信できること、そして、小児てんかんの子どもたちのような脆弱な患者を、重金属や農薬といった汚染から守れることを意味します。
標準化の代償
ただし、標準化には代償も伴います。
患者の多くは、主要カンナビノイドから微量成分まで、配合比の異なる多様な製品の中から、自分の症状に合ったものを選べることを重視してきました。
ところが、再分類による「医薬品化」システムの下では、当初はごく少数の標準化された製剤しか生まれず、非伝統的な配合で救われてきた人たちが、取り残されてしまう恐れもあります。
患者が突きつけられる問い
患者にとっての核心的な問いは、こうです。
再分類は、安全で信頼できる選択肢を本当に広げるのか。
それとも、大手製薬企業が「採算が取れる」と判断した、限られた製品だけに狭めてしまうのか。
法的地位、根強い偏見、そして健康格差
大麻を利用する人々は、雇用主や医療従事者からの偏見や差別に直面することが少なくありません。
その結果、患者は医師に使用を打ち明けるのをためらい、治療計画が複雑になったり、薬の相互作用というリスクにさらされたりします。
さらに、法的な不安も残ります。
ある州では合法であっても、別の状況では親権や住居、仕事を失う可能性があるのです。
退役軍人が直面する矛盾
とりわけ退役軍人は、複雑でねじれた連邦規制の網の中に置かれています。
VA(退役軍人省)の医師は、原則として大麻を推奨することができません。
ただし最近、下院を通過したVA予算法案では、医師が退役軍人と医療用大麻について話すことすら禁じてきた制限を、見直そうとする動きも出ています。
再分類がもたらす「シグナル」
再分類は、こうした状況の一部を和らげる可能性があります。
連邦政府が大麻に「認められた医療用途」があると公式に認めれば、それは保険会社や医療提供者、そして社会全体に対して、極めて強いメッセージを送ることになります。
患者と医師の対話がより自然なものとなり、偏見が薄れ、開かれた協調的な医療が促されるでしょう。
それでも残る「公平性」の課題
しかし、公平性の問題は依然として残ります。
住んでいる場所、人種、所得によってアクセスには大きな差があり、歴史的に大麻所持で過剰な取り締まりを受けてきたコミュニティが、再分類によってすぐに刑事化から解放されるわけではありません。
また、遠隔地や医療資源の乏しい地域の患者は、都市部に比べて製薬ルートへのアクセスが難しい状況が続くでしょう。
魔法の解決策ではない
再分類は、こうした不平等を一気に解消する「魔法の弾丸」ではありません。
それはあくまで、除外(descheduling)という本当の転換点へ向かう、正しい方向への一歩にすぎないのです。
結論

大麻の再分類は、単なる官僚的な「椅子取りゲーム」ではありません。
それは、患者がどのように医療にアクセスし、どれだけの負担で薬を手にし、医療システムの中でどう位置づけられるのか?その在り方そのものを変え得る動きです。
同時に、負担可能性、公平性、治療選択肢の多様性という、新たな問いも私たちに突きつけます。
患者にとって、この問題の賭け金はきわめて個人的です。
再分類は、スティグマから正当性へ、不確実性から一貫性へ、自己負担から保険適用へ――そんな転換をもたらし、困窮する人々にとっては、人生を変えるアクセスになるかもしれません。
しかしその一方で、大麻が高度に商業化された製薬産業の枠組みに組み込まれることで、これまでになかった新たな課題に直面することにもなります。
政策立案者や規制当局が制度をめぐって議論する中で、患者の存在は、私たちに本当に大切なものを思い出させてくれます。
それは、市場や法律の話だけではなく、尊厳と健康、そして希望をもって生きる、一人ひとりの人生そのものなのだということです。
『BTAカナビスCPAタックス(BTA Cannabis CPA Tax)』トーマス・アンダーセンによる寄稿(2025年11月24日)
※当サイトでご紹介する商品は、医薬品ではありません。また、病気の診断、治療、予防を目的としたものでもありません。
※記事はアメリカでの法律、
※本記事を転載、または引用をされる場合は、情報元としてサイト名(CBD Library)と当URLの掲載をお願いいたします。
\日本最大級の品揃え。CBDオイル専門の通販セレクトショップ/